前沿| 皮肤的修复“神器”:干细胞外泌体
本文首发自博雅干细胞,作者 武汉大学 Chen
专家审核:江苏大学附属医院 李晶 教授
近年来,干细胞外泌体被广泛应用到了疾病的临床治疗研究中,比如此次新冠肺炎的临床救治探索中也应用到了干细胞外泌体,此外在诸如阿尔兹海默症、子宫内膜损伤等疾病的治疗研究中也出现了干细胞外泌体的身影。
科学研究已经发现,干细胞外泌体具有修复损伤的功能。随着科技的发展,干细胞外泌体在损伤修复中表现出了巨大的潜力。今天,我们就来揭示干细胞外面修复损伤的神秘面纱。
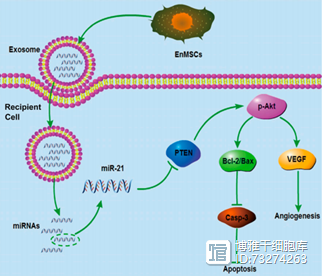
干细胞外泌体的由来 说到外泌体,要从1984年科学家发现的“囊泡释放”说起——麦吉尔大学研究团队发现羊网织红细胞的转铁蛋白受体在体外成熟为红细胞的过程中被切除,并以囊泡形式释放[1]。1987年,他们将羊网织红细胞分泌的一些小囊泡命名为外泌体(exosome)[2]。 图1:1984年,Johnstone等人首次发现的外泌体电镜图 外泌体是经胞内体内陷形成多囊泡体后,与细胞膜结合进而释放到细胞外的小囊泡。外泌体包含丰富的蛋白质、RNA及DNA,这些生物活性因子能够在细胞间被稳定地转运。外泌体直径约为30-160nm,电子显微镜下呈椭圆状或板状,由双层磷脂分子包围而成,能够介导细胞之间的信息交流。我们可以把它称之为“通讯员”。 干细胞可以通过旁分泌的作用来分泌外泌体。间充质干细胞是干细胞家族中的重要成员,具有自我更新、多向分化、免疫调节和分泌多种活性物质的功能,是组织再生的重要干细胞群,也被称为“种子细胞”。越来越多的研究表明,间充质干细胞外泌体在组织损伤修复中可能发挥关键作用。 干细胞外泌体与干细胞具有相似的生物学性能,但干细胞外泌体更加安全稳定高效,具有更强而复杂的信号分子转运和调控能力,为无细胞移植治疗的情况下实现组织再生、组织修复提供了新策略、新方法。 图3:2017年,Wang等人发现microRNA-21的机理是作用于靶基因PTEN后,激活下游的PTEN/Akt信号转导,发挥促进血管新成和抗心肌细胞凋亡的作用。该图是由En MSCs分泌microRNA-21外体介导的高级心脏保护示意图[4]。 干细胞外泌体与皮肤修复 皮肤约占人体表面积的70%,是具有保护身体、排汗、感觉温度变化的最大器官,同时还参与机体免疫反应。常见的皮肤损伤包括创伤、烫伤、烧伤等,其中难愈性皮肤损伤和损伤后引起的严重瘢痕甚至会导致畸形,给患者带来极大的肉体和精神上的折磨。同时,外部环境刺激也会导致皮肤衰老损伤。 近年来,研究人员将外泌体与皮肤疾病联系起来,发现外泌体不仅参与皮肤生理、病理过程,如调节皮肤微环境中促炎细胞因子分泌,促进皮肤缺损处血管新生及胶原沉积,以及调节皮肤成纤维细胞增殖分化,同时还在皮肤微环境发生病变时发挥特异性信息传递作用。 研究表明,间充质干细胞真正到达损伤部位并增殖分化为特定组织类型细胞仅是其修复损伤组织的冰山一角。间充质干细胞进行损伤修复的主要机制是旁分泌作用,即通过干细胞分泌外泌体进行损伤修复。间充质干细胞外泌体具有促进血管新生、抑制瘢痕形成的功能。这其中的调控机理又是什么呢? 第一,间充质干细胞的外泌体能够显著促进创面的愈合。2015年发表的研究发现,间充质干细胞外泌体中含有有丰富的Wnt蛋白,它能活化β-catenin信号通路,同时通过激活Erk1/2信号通路正调控VEGFA、Cox-2、FGF2等(成血管基因)的表达,进而促进了二度烧伤大鼠模型深部创伤后血管的重生、胶原蛋白合成和皮肤损伤修复[5]。 图4:2015年,Zhang等人发现间充质干细胞的外泌体通过促进血管新生修复皮肤 第二,间充质干细胞外泌体能够抑制缺损皮肤中肌成纤维细胞的过度聚集和瘢痕形成。肌成纤维细胞是在皮肤损伤修复中起组织收缩作用的细胞,但是,肌成纤维细胞持续存在会引起创伤面过度收缩,导致増生性瘢痕。2016年,科学研究发现外泌体中富含 microRNAs(microRNA-23a,microRNA-21等),其通过阻断TGF-β/SMAD2信号通路,抑制小鼠模型肌成纤维细胞的形成[6]。 图5:2016年,Fang等人发现间充质干细胞的外泌体抑制瘢痕形成。 展望 干细胞外泌体不仅在临床上用于烧伤、皮肤溃疡、创伤等受损皮肤的修复治疗,并且在改善肤质、修复衰老中毒皮肤等也有功效。此外,在心血管系统、外伤性脑损伤、肌肉骨骼系统、肝损伤、肾损伤等方面都展现出强大的修复再生和保护能力。干细胞外泌体能够激活多种信号通路,通过调节基因的表达,促进靶器官相关细胞活化、增殖,进而修复损伤,有望成为再生医学的一种新兴的修复工具,打破不可逆损伤这一修复障碍,使再生成为可能。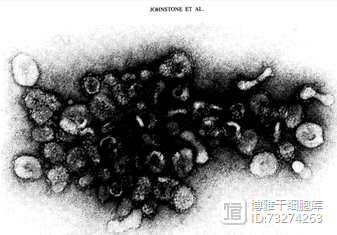
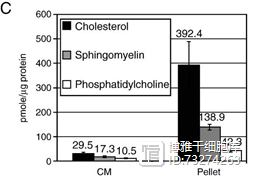
图2:2010年,Reunn等人首次报道了MSCs培养基中具有心肌保护功能的成分是间充质干细胞释放的外泌体。它是由胆固醇、鞘磷脂和磷脂酰胆碱组成的磷脂囊泡[3]。